熔点、熔化热与熔点降低常数
熔点、熔化热与熔点降低常数
物质在其蒸气压下液体固体达到平衡状态时的温度称为熔点或凝固点。这是由于固体中原子或离子的有规则排列因温度上升热运动变成杂乱而活化,形成不规则排列的液体的一种现象,相反的过程即为凝固,酒精的凝固点为-114.50C。纯物质的熔化或凝固的温度范围通常是很狭小的,即有着固定的熔点或凝固点。当混入杂质时,熔点明显降低。因此利用熔点的测定可以检验物质的纯度。例如当A物质中溶解有少量B物质时,则A物质的熔点下降。如果A,B混合物是由理想溶液组成(即溶质与溶剂混合成为溶液时,既不放热,也不吸热,溶液体积恰好等于溶质体积和溶剂体积之和),其熔点下降(△T)可用下式表示
△T=-RTo/△H*logNA
式中NA—A物质的摩尔分率;
△H—溶剂1mol的熔化热。
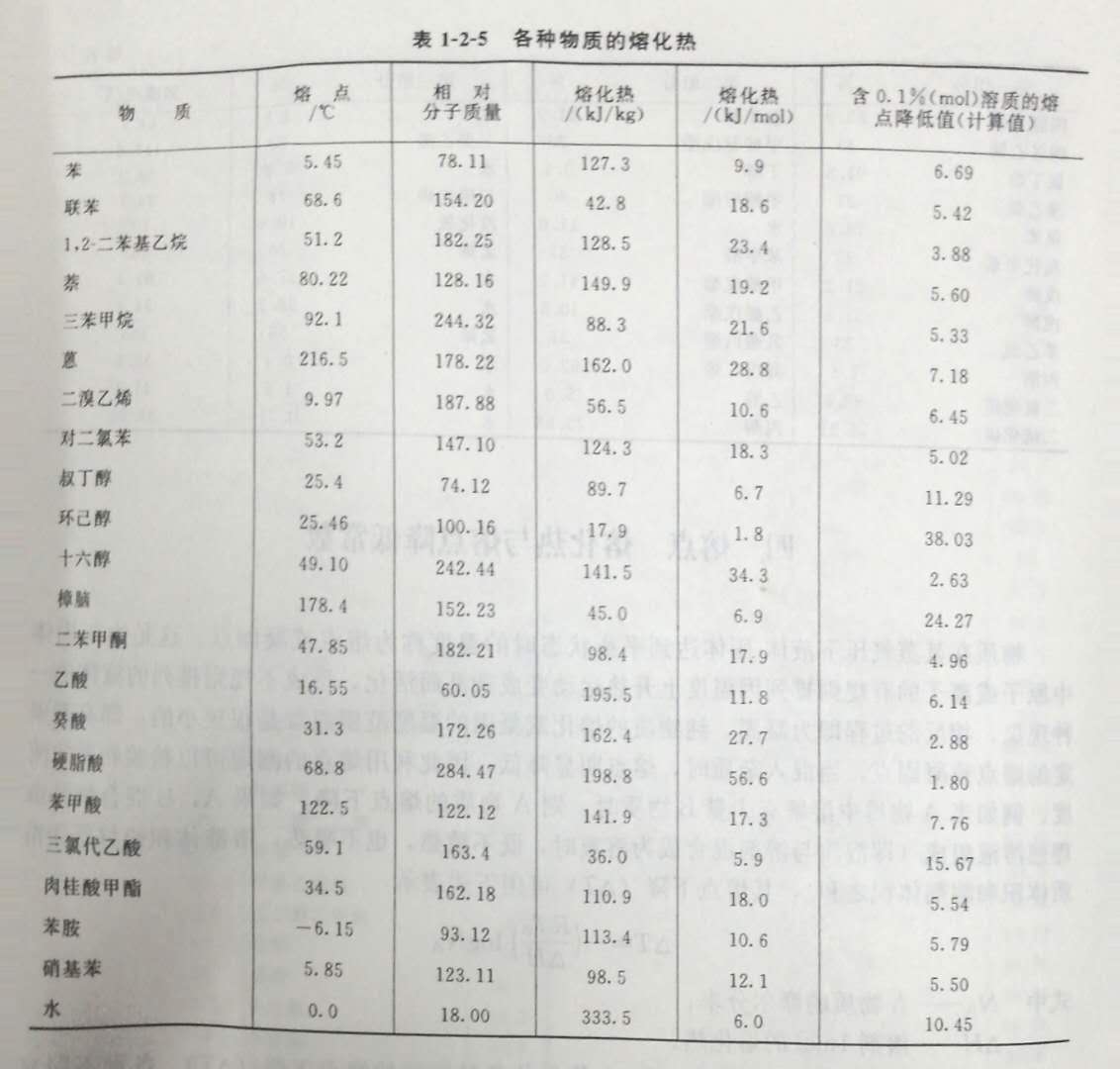
由上式可以求出含有0.1%(mol)A物质的各种溶液的熔点下降(△T)。各种不同溶剂的熔点降低常数是不同的,由熔点降低法测定分子量就是根据这个原理进行的。表1-2-4为各种溶剂的熔点降低常数(F)。
表1-2-4熔点降低常数

熔化热是指在101.3kPa下单位质量的晶体物质在熔点时从固态全部变成液态时所吸收的热量。表1-2-5为各种物质的熔化热。